现有16g Fe2O3和CuO的混合物.进行如下实验,把混合物全部加入到100克足量的硫酸溶液中.完全溶解后.滴加溶质质量分数为16%的氢氧化钠溶液.滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示.回答下列问题:(1)写出上述实验过程中会生成红褐色沉淀的化学方程式:6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4.(2)当所加氢氧化钠溶液质 题目和参考答案——青夏教育精英家教网——
4. 现有16g Fe2O3和CuO的混合物,进行如下实验;把混合物全部加入到100克足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示,回答下列问题:
现有16g Fe2O3和CuO的混合物,进行如下实验;把混合物全部加入到100克足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示,回答下列问题:
(1)写出上述实验过程中会生成红褐色沉淀的化学方程式:6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4.
(2)当所加氢氧化钠溶液质量为20g时,混合液中的溶质有Fe2(SO4)3、H2SO4、CuSO4、Na2SO4.
(3)求CuO的质量.
分析 (1)氧化铁与硫酸反应生成硫酸铁和水,硫酸铁与氢氧化钠反应生成氢氧化铁和硫酸钠;
(2)氧化铁与硫酸反应生成硫酸铁和水,氧化铜与硫酸反应生成硫酸铜和水,由于加入足量的硫酸溶液,再滴加氢氧化钠溶液时,氢氧化钠优先于硫酸反应;
(3)根据电荷守恒知道,铁和铜所带正电荷总数必与氢氧根离子所带负电荷总数相等.
解答 解:(1)氧化铁与硫酸反应生成硫酸铁和水,硫酸铁与氢氧化钠反应生成氢氧化铁和硫酸钠,方程式为:6NaOH+Fe2(SO4)3=2Fe(OH )3↓+3Na2SO4;
(2)氧化铁与硫酸反应生成硫酸铁和水,氧化铜与硫酸反应生成硫酸铜和水,由于加入足量的硫酸溶液,再滴加氢氧化钠溶液时,氢氧化钠优先于硫酸反应,当所加氢氧化钠溶液质量为20g时,氢氧化钠还没有把硫酸消耗完,所以混合液中的溶质有Fe2(SO4)3、H2SO4、CuSO4、Na2SO4;
(3)设Fe2O3的质量为x,CuO的质量为y.
则有x+y=16g--①
根据电荷守恒知道,铁和铜所带正电荷总数必与氢氧根离子所带负电荷总数相等.可得方程
x160" role="presentation">x160×2×3+y80" role="presentation">y80×1×2=(150g−25g)×1640" role="presentation">(150g−25g)×1640--②
有①②解得x=y=8g
故答案为:(1)6NaOH+Fe2(SO4)3=2Fe(OH )3↓+3Na2SO4;
(2)Fe2(SO4)3、H2SO4、CuSO4、Na2SO4;
(3)8g.
点评 此题是数形结合类问题,分析反应的关系图是正确判断反应进行的依据和基础.弄清折点的含义,是解决此题的关键之所在.
练习册系列答案

更多初中、高中辅导课程推荐,点击进入>>
相关习题
科目:初中化学来源:题型:解答题
14.某实验小组对久置的生石灰进行分析,操作及部分实验现象如图所示.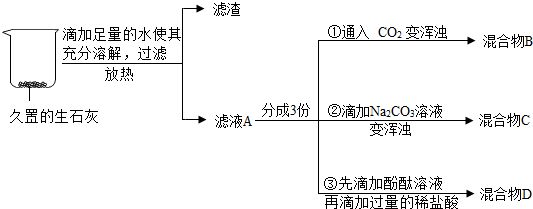
(1)样品加水放热的原因是(用化学方程式表示)CaO+H2O═Ca(OH)2.
(2)①中发生反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O.
(3)③中的实验现象是滴加无色酚酞溶液,溶液由无色变成红色;再滴加过量稀盐酸,溶液由红色变成无色,发生反应的化学方程式为Ca(OH)2+2HCl═CaCl2 +2H2O.
查看答案和解析>>
科目:初中化学来源:题型:解答题
15.请结合图示实验装置,回答下列问题.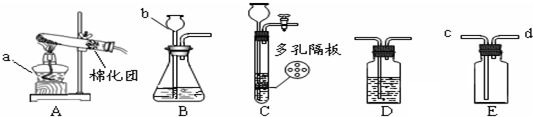
(1)图中a、b仪器的名称:a酒精灯,b长颈漏斗.
(2)用高锰酸钾固体制氧气,选用的发生装置是A(填“A”、“B”或“C”),装入药品前应先检查装置气密性,反应的化学方程式是2KMnO4△_" role="presentation">△_K2MnO4+MnO2+O2↑,该反应的基本类型为分解反应.
(3)某同学在实验室用C装置(多孔隔板用来放块状固体)制取氢气,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑,该反应的基本类型为置换反应.C装置与B装置相比较,优点为能够随时使反应进行或停止(答出一点即).
(4)实验室用B装置制取二氧化碳时,b中应加入稀盐酸.反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O,如要获得干燥的气体,除发生装置外,还应选用盛放浓硫酸(填写试剂名称)的D装置.如用E装置收集CO2,则气体应从c端通入(填“c”或“d”).
查看答案和解析>>
科目:初中化学来源:题型:选择题
12.下列药品与水接触后,温度降低的是( )
A.烧碱B.硝酸铵C.浓硫酸D.氯化钠查看答案和解析>>
科目:初中化学来源:题型:选择题
19.常温下,饱和石灰水的pH约为11.3,现往一定量饱和石灰水中加入下列固体物质,恢复到常温时,溶液的pH一定不会发生改变的是( )
A.NaOHB.MgCl2C.Na2CO3D.CaO查看答案和解析>>
科目:初中化学来源:题型:选择题
9.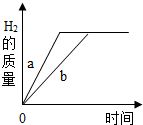 质量相等的两种金属a和b,它们都能与稀硫酸发生反应并产生氢气,反应情况如图所示,则下列有关a、b的活动性和参加反应的稀硫酸的质量的说法中,正确的是( )
质量相等的两种金属a和b,它们都能与稀硫酸发生反应并产生氢气,反应情况如图所示,则下列有关a、b的活动性和参加反应的稀硫酸的质量的说法中,正确的是( )
①a比b活泼 ②b比a活泼 ③酸不足 ④酸过量.
查看答案和解析>>
科目:初中化学来源:题型:填空题
16.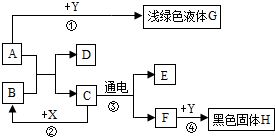 如图所示,A~H是初中化学常见的物质,A和B可发生中和反应,C为生活中最常见的液体,F可供给呼吸,X常用作食品干燥剂,Y为单质,请根据图示回答下列问题:
如图所示,A~H是初中化学常见的物质,A和B可发生中和反应,C为生活中最常见的液体,F可供给呼吸,X常用作食品干燥剂,Y为单质,请根据图示回答下列问题:
(1)B的俗名为熟石灰或消石灰.
(2)H的化学式为Fe3O4.
(3)反应②的化学方程式为:CaO+H2O=Ca(OH)2.
(4)反应④的反应条件点燃.
(5)若向G中加入硝酸钡和硝酸的混合液,有白色沉淀出现,则D的化学式为:CaSO4.
(6)写出E的一条化学性质可燃性(或还原性),因此E可用来燃料(或还原剂).
查看答案和解析>>
科目:初中化学来源:题型:多选题
13.据2015年央视315晚会曝光,山东省东营市、滨州市许多不法厂商生产不合格的“调和汽油”,生产的93号汽油是把一部分90号的汽油配上大量的石脑油、芳烃和MTBE(抗暴剂)等各种化工原料简单混合而成.这种汽油损害汽车,污染环境,影响健康.MTBE的化学式为CH3OC(CH3)3. 以下关于MTBE的说法中,不正确的是( )
A.“MTBE”是一种有机物B.一个“MTBE”分子由18个原子构成C.“MTBE”分子中,碳、氢、氧的质量比为5:12:1D.“MTBE”完全燃烧后,生成水和二氧化碳的质量比为55:27查看答案和解析>>
科目:初中化学来源:题型:解答题
14.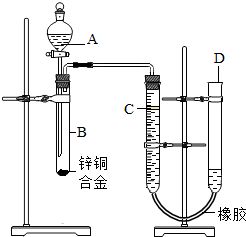 某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是除去合金表面的氧化膜;
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温后,记录C的液面位置;③由A向B滴加足量试剂;④检查气密性.
上述再进行的操作的顺序是④①③②(填序号);
(3)该装置的气密性的检验方法是打开分液漏斗旋塞,从D管注入经济易得的水,使U型管左右液面相平,关闭分液漏斗旋塞,提高D管,观察到液面不再下降,说明装置的气密性好;
(4)待B中不再有气体产生,记录C的液面位置前,需将温度恢复至室温和调节D管使左右液面相平;
(5)若实验用锌铜合金的质量为ag,与稀硫酸充分反应后,测得氢气体积为V L,为求出合金中铜的质量分数,还缺少的一个数据是D;
A.反应前加入稀硫酸的体积 B.反应前加入稀硫酸的质量分数
C.实验前反应装置中空气的体积 D.实验条件下氢气的密度
(6)实验过程中,若未冷却就读取气体体积,则测得锌的质量分数将偏大(填“偏大”、“偏小”或“不受影响”).
(7)可指导老师认为,利用上述实验装置,测量结果总会偏小,原因是有一部分氢气留在试管和导管中,改进方法是可以加水把氢气赶过去.
查看答案和解析>>
同步练习册答案
相关知识
写出下列反应的化学方程式或离子方程式:(1)工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3.反应的化学方程式为SO2+Na2SO3+H2O=2NaHSO3.(2)现有:①澄清石灰水,②偏铝酸钠溶液.在上面两种溶液分别通入过量的CO2.写出所发生反应的离子方程式:①CO2+OH
实验室有一瓶长期放置的氢氧化钠固体.某兴趣小组同学欲对该固体变质情况进行探究.Ⅰ固体的成分分析[提出问题]该瓶氢氧化钠固体是否变质.变质情况如何?[查阅资料]①氢氧化钠在空气中容易变质但不会转化为NaHCO3,②CaCl2溶液的pH=7.碳酸钠溶液的pH?7③CaCl2+Na2CO3═CaCO3↓+2NaClCa(OH)2+Na2CO3═CaCO3↓+2NaOH 题目和参考答案——青夏教育精英家教网——
【将PH=3的硝酸溶液和PH=10的氢氧化钡溶液相混合,使混合后溶液的PH=7,则硝酸溶液和氢氧化钡溶液的体积比为?硝酸与氢氧化钡的物质的量之比为?】
[题目]某研究小组对过氧化氢溶液制取氧气进行如下探究:实验一 探究H2O2质暈分数.溶液pH.温度对反应速率的影响(1)实验室用过氧化氢溶液制氧气的化学方程式为 .(2)设计如下表实验方案实验序号H2O2质量分数/%pH温度/℃每分钟气泡数130520230620330112041511305a11b①实验1
碱式碳酸铜的成分有多种.其化学式一般可表示为aCu(OH)2·bCuCO3.确定某碱式碳酸铜的化学式的方法为:取一定质量的固体加热至质量不再减少.测得反应后残留固体质量为24g.产生二氧化碳8.8g.则a.b的关系正确的是A. a:b=2:1 B. a:b=1:1 C. a:b=3:2 D. a:b=1:2 D [解析]碱式碳酸铜加热分解生成氧化铜.二氧 题目和参考答案——青夏教育精英家教网——
将少量生石灰加入盛有饱和石灰水的烧杯中.冷却到室温.烧杯底部出现白色固体.下列说法 错误如是A.反应发生的化学方程式为:Ca0+H20=Ca(0H)2B.白色固体的主要成分为:Ca(OH)2C.冷却到室温过程中Ca(0H)2溶液的溶质质量分数始终保持不变D.反应后.溶液里溶质Ca(0H)2的质量减小 题目和参考答案——青夏教育精英家教网——
30. (1)碱过量会使产物中有氢氧化铁生成.影响纯度, (2)纸上层析,Fe3++3NH3·H2O=Fe(OH)3↓+3NH44, Cu2++4NH3·H2O=Cu(NH3)42++4H2——青夏教育精英家教网——
[干货]高中化学“过量、少量”问题化学方程
侯德榜是我国著名的化学家.发明了侯氏制碱法,其反应原理如下:NaCl+CO2+NH3+H2O = NaHCO3+NH4Cl,请计算:(1)氯化铵中氮元素的质量分数 .(2)生产8.4t碳酸氢钠.理论上需要氯化钠的质量 . 题目和参考答案——青夏教育精英家教网——
下列各组物质,能在PH=2的溶液中大量共存,且形成无色溶液的是:(
网址: 现有16g Fe2O3和CuO的混合物.进行如下实验,把混合物全部加入到100克足量的硫酸溶液中.完全溶解后.滴加溶质质量分数为16%的氢氧化钠溶液.滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示.回答下列问题:(1)写出上述实验过程中会生成红褐色沉淀的化学方程式:6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4.(2)当所加氢氧化钠溶液质 题目和参考答案——青夏教育精英家教网—— https://www.trfsz.com/newsview1855951.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828






