Cl2+SO2+2H2O=4H++2Cl
下列离子方程式,不正确的是( )
A.氯水中通入SO2: Cl2+SO2+2H2O=4H++2Cl-+
B.碳酸氢钙溶液中加入过量NaOH溶液:Ca2+++OH-=CaCO3↓+H2O
C.碳酸氢铵溶液与足量的氢氧化钠溶液混合:
++2OH-=NH3•H2O+H2O+
D.金属Cu与稀硝酸反应:3Cu+8H++2=3Cu2++2NO↑+4H2O
练习册系列答案
相关习题
科目:高中化学来源:题型:
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如图1: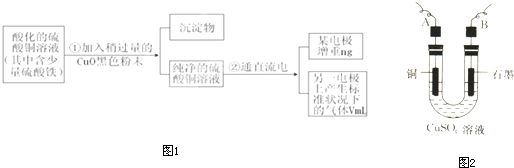
回答下列问题:
(1)加入CuO的作用是
消耗H+而调整溶液的pH使之升高,使Fe3+完全水解形成Fe(OH)3沉淀而除去
消耗H+而调整溶液的pH使之升高,使Fe3+完全水解形成Fe(OH)3沉淀而除去
.
(2)步骤②中所用的部分仪器如图2所示,则A、B分别连直流电源的
负
负
和
正
正
极(填“正”或“负”).
(3)电解开始后,在U形管中可以观察到的现象有:
铜棒变粗,石墨极上有气泡生成,溶液的颜色变浅
铜棒变粗,石墨极上有气泡生成,溶液的颜色变浅
.电解的离子方程式为
2Cu2++2H2O2Cu↓+O2↑+4H+;
2Cu2++2H2O2Cu↓+O2↑+4H+;
.
(4)下列实验操作中必要的是
abde
abde
(填写字母).
a.电解前的电极的质量;b.电解后,电极在烘干称量前,必须用蒸馏水冲洗;c.刮下电解后电极上析出的铜,并清洗,称量;d.电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;e.在有空气存在的情况下,烘干电极必须用低温烘干的方法.
(5)铜的相对原子质量为
(用带有n、V的计算式表示).
查看答案和解析>>
科目:高中化学来源:题型:
如图是化学实验室中常用制备、干燥气体的部分仪器装置.某学校同学利用中学常用试剂及仪器设计下列实验.
(1)甲同学利用如图I装置制备并收集干燥的NO2气体,请完成下列问题: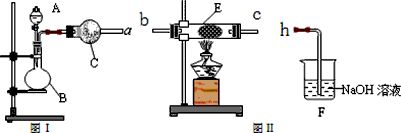
①图I中仪器B的名称:
圆底烧瓶
圆底烧瓶
;②收集NO2的方法
向上排气法
向上排气法
;
③B中发生反应的离子方程式为
3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑
3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑
.
④将收集满NO2的集气瓶浸入冰水中,烧瓶内气体颜色
变浅
变浅
(填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因
2NO2?N2O4△H<0,降低温度,平衡向放热方向即正反应方向移动,导致二氧化氮气体的浓度降低
2NO2?N2O4△H<0,降低温度,平衡向放热方向即正反应方向移动,导致二氧化氮气体的浓度降低
.
(2)乙同学利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质.A中加入浓氨水,B中加入过氧化钠固体,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器 a→b→c→h.请完成下列问题:
①实验中观察到E内有红棕色气体出现,证明氨气具有
还原
还原
性;
②E中发生反应的化学方程式为
4NH3+5O24NO+6H2O;2NO+O2=2NO2
4NH3+5O24NO+6H2O;2NO+O2=2NO2
.
查看答案和解析>>
科目:高中化学来源:题型:
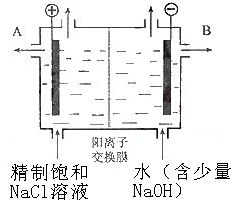 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
(1)A极为电解槽的
阳
阳
极(正、负、阴、阳),电极反应式为
2Cl-→2e-+Cl2↑
2Cl-→2e-+Cl2↑
.
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许
Na+
Na+
(填离子符号,下同)通过,而不允许
Cl-、OH-
Cl-、OH-
和气体通过.
(3)电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3 ③BaCl2④盐酸,这四种试剂的添加顺序为
③②①④
③②①④
(填序号).
(4)若将标准状况下6.72升阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,电子转移数是0.5×6.02×1023,产物中得到了两种含氯化合物,写出该反应的离子方程式:
3Cl2+6OH-5Cl-+ClO3-+3H2O
3Cl2+6OH-5Cl-+ClO3-+3H2O
.
查看答案和解析>>
科目:高中化学来源:题型:
(2010?扬州模拟)实验室用共沉淀法制备纳米级Fe3O4的流程如下: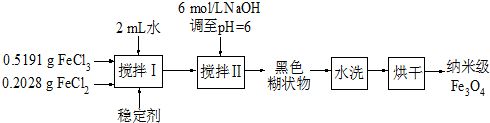
该方法的关键为促进晶粒形成,并控制晶体生长.试回答下列问题:
(1)该反应原理的离子方程式可表示为
Fe2++2Fe3++8OH-=Fe3O4+4H2O
Fe2++2Fe3++8OH-=Fe3O4+4H2O
.
(2)反应温度需控制在50℃,其方法是
水浴加热
水浴加热
,温度偏低造成产量低的可能是
温度低时反应缓慢
温度低时反应缓慢
.
(3)在搅拌Ⅱ的过程中还需加入10mL正丙醇,其作用是
降低Fe3O4的溶解度(使其易达到饱和,促进晶粒形成)
降低Fe3O4的溶解度(使其易达到饱和,促进晶粒形成)
.
(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是
取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净.
取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净.
.
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条)
反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等)
反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等)
.
查看答案和解析>>
科目:高中化学来源:题型:阅读理解
(1)现有下列五种物质
A.食盐 B.食醋 C.苹果 D.葡萄糖 E.青霉素
请选出一种物质填在相应的横线上 (填序号).
以上物质中,属于碱性食物的是
;可直接进入血液,补充能量的是
;应用最广泛的抗生素之一的是
;既可作为咸味剂,又可作为防腐剂的是
;食用过多会引起血压升高、肾脏受损的是
.
(2)阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
①在人体中进行Fe2+Fe3+的转化时,①中的Fe2+作
剂,②中的Fe3+作
剂;
②“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中体现
性;
③市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的化学方程式为
.
(3)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质.某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉.
①写出该抗酸药发挥功效时的离子方程式:
、
.
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)
.
查看答案和解析>>
相关知识
已知还原性Cl
造成空气污染的有因素和 因素,一般以后者为主。主要污染物有:、、 、及 等。①汽车尾气中主要有害成分:、、以及 等,为主要的空气污染源之一。②可吸入颗粒物:粒径在 以下的颗粒物,是各大城市的污染物。
已知Fe2+和Cl2在溶液中因发生氧化还原反应而不能大量共存.现将过量的Cl2通入FeBr2溶液中.下列离子方程式正确的是 A.Cl2+2Br
(1)已知:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=
孕妇能用84消毒液洗衣服吗
下列有机反应属于加聚反应的是( )A.CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HClB.nCH2=CH2$\stackrel{一定条件}{→}$C.+HNO3$→ {加热}^{浓硫酸}$+H2OD.2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 题目和参考答案——青夏教育精英家教网——
用双线桥法标出下列氧化还原反应中电子的转移及个数,并指出氧化剂、还原剂。①2H2S+O2=2S+2H2O
氯气对人体的危害有哪些
完成下列内容:(1)AsH3是一种很强的还原剂.室温下.它能在空气中自燃.其氧化产物为As2O3写出该反应的化学方程式:2AsH3+3O2=As2O3+3H2O.(2)白磷在一定条件下可被HClO3的水溶液氧化.生成磷的最高价态化合物.而氯元素被还原为最低价态.写出该反应的化学方程式:3P4+10HClO3+18H2O=10HCl+12H 题目和参考答案——青夏教育精英家教网——
大气污染
网址: Cl2+SO2+2H2O=4H++2Cl https://www.trfsz.com/newsview421703.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828






