脂肪因子:连接肥胖与痴呆(柳叶刀综述)
通过身体质量指数或中央肥胖 (
腰围 )
测得的超重与肥胖,和脑萎缩、脑白质改变、血脑屏障完整性破坏相关,并且能够增加晚发型痴呆与阿尔茨海默病的风险。这种相关性促使我们提出“为何身体质量指数与脑健康及痴呆风险相关”的疑问。因为在人类观察性试验与临床研究中显示脂肪因子与痴呆具有相关性,所以近期柳叶刀杂志发表最新综述,详细探讨了脂肪因子,在这种相关性中扮演的角色。具体内容如下:
摘要
自 2003
年起,首篇报道“在女性中,阿尔兹海默病风险与更高 BMI
值相关”的文章发布之后,关注中晚年 BMI
值与痴呆风险的研究逐渐增多。例如,有研究提示,中年 BMI
值增高或中央肥胖的患者,晚年发生痴呆的风险升高两倍。依据 BMI、腰围以及预测心血管风险和整体死亡率的腰围 -
臀围比率(WHR)确定的超重与肥胖患者,脂肪因子水平与痴呆或阿尔茨海默病间具有相关性。而中年过后,BMI
值趋于下降,与没有痴呆的患者相比,临床痴呆患者,BMI
或体重更低。
表一:肥胖测量方式及界定范围
身体质量指数(BMI)
中心(腹部)肥胖
腰臀围比值(WHR)
常用肥胖诊断指标,即体重(kg)/身高2(m2);1kg/ m2 =1单位的BMI
以厘米或英寸计算腰围
腰围与臀围的比值
<18.5 kg/ m2 =低重;
18.5-24.9 kg/ m2 =正常;
25.0-29.9 kg/ m2 = 超重;
≥30 kg/ m2 =肥胖;
≥40 kg/ m2=III级肥胖;
男性≤102 cm (≤40 inches)=健康;
女性≤88 cm (≤35 inches)=健康
男性<0.90健康;
女性<0.80健康
这种相反的流行病学研究结果引起激烈的讨论(图一)。中年肥胖与痴呆风险增加相关,可能由于血管机制的参与;而晚年 BMI
值与体重的下降,可能反映了神经退行性病变过程以及稳态的破坏。但是 BMI、腰围、WHR
值通过什么转化为痴呆风险上的差异?答案之一是白色脂肪组织(WAT)的含量以及分泌能力。
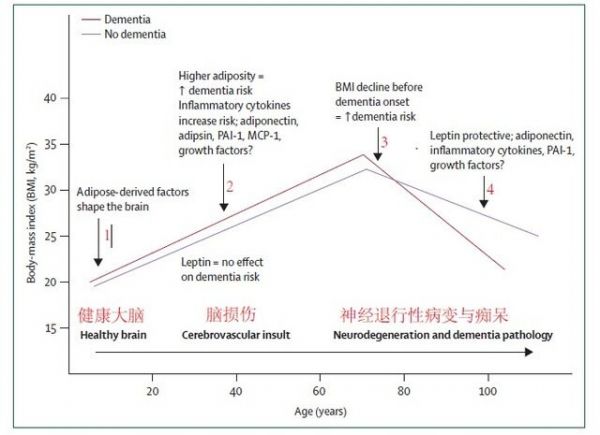
图一:可能与痴呆相关的 BMI
轨迹(脂肪因子可能参与:能量平衡、代谢、血栓、高血压、炎症等过程)
图注:红线代表 --
痴呆;紫线代表 --
没有痴呆。 箭头从左到右,箭头 1:脂肪来源的因子形成大脑; 箭头 2:肥胖 --
痴呆风险的增加 (炎症细胞因子增加风险;脂联素、降脂素、PAI-1、MCP-1、生长因子作用不确定),下方:瘦素 --
对痴呆风险没有影响; 箭头 3:在痴呆发病前 BMI
值的降低,意味着痴呆风险的增加; 箭头 4:瘦素具有保护作用;脂联素、炎性细胞因子、PAI-1、生长因子作用不确定
WAT
是内分泌组织,可以分泌上百种细胞信号分子,即脂肪因子。脂肪组织的内分泌功能,可能提供了脂肪组织与主要神经退行性变以及衰老相关血管疾病(认知障碍、痴呆)间的有关线索。其它潜在影响脂肪组织与痴呆风险的因素包括:缺乏体育锻炼、饮食构成(营养、非营养)、饮食习惯、健康与疾病状态、遗传背景,但是对这些因素的探讨超出了本文的范围。本篇综述,主要定义并且讨论了脂肪因子的潜在作用。
脂肪组织与脂肪因子
WAT
是一种复杂的组织,由基质层与成熟脂肪细胞层构成。基质层又由脂肪来源干细胞或前脂肪细胞、成纤维细胞、血管以及神经细胞组成。脂肪来源性干细胞可以自我更新,并且能够分化为脂肪细胞、成骨细胞、肌细胞、软骨细胞、内皮细胞、心肌细胞甚至神经元样细胞。而成熟的脂肪细胞层由完全分化的脂肪细胞组成。
脂肪因子包括上百种由 WAT
细胞分泌的多肽类物质,有时被称为脂肪分泌或 adipokinome。相比于皮下 WAT,内脏脂肪组织能够释放更多的脂肪因子。由于内脏脂肪组织与腰围增加或 WHR
值相关,而非单纯确定身体肥胖的方法(例如人体测量),因此被用于研究作用机制。相似的,BMI
主要反应成人整体脂肪情况,具有相对良好的相关性,无论身体组成随年龄发生何种变化。
Adipokine(脂肪因子) 或 adipocytokine(脂肪细胞因子),主要由 adipose (
脂肪 /adipo-),cell(细胞 /-cyto-)与 movement(运动 /-kinos)组成。脂肪因子最初意味着由脂肪组织分泌的免疫调节性细胞因子。但随着这一词语的广泛使用,其含义也得到扩展。目前脂肪因子,
可以代表细胞因子、急性期反应物、生长因子、其它炎性介质、脂肪组织分泌的激素(如瘦素)、以及其他化学信使。
脂肪因子通过自分泌、旁分泌、内分泌等机制发挥作用,有的脂肪因子能够同时影响外周与中枢神经系统进程。瘦素、脂联素、白细胞介素 -6(IL-6) 是 3
种广为人知的与痴呆相关的脂肪因子。人体除脂肪组织外,中枢神经系统(CNS)内脂肪含量最高。在 CNS
中,脂肪并不存储于脂肪组织中,而是通过脂肪酸组成髓鞘层,继而包绕脑与脊髓内的轴索。
CNS
来源的脂肪因子可以由不同脑区内的非脂肪细胞类型与核团生成,例如调节饮食行为的下丘脑弓状核。另一方面,由于痴呆所报道的神经退行性病变与血管病变进程,能够影响多个脑区及核团;因此在神经退行性病变与血管病变过程中,脂肪因子可能被改变,并通过反馈作用加剧神经退行性病变进程,尽管尚未被证实。
由于疾病或潜在功能受损,肥胖与老年个体的脂肪因子释放可能失调。而词语 Inflamm-agin(炎症导致老化)与 adiposopathy(脂肪病变 ),代表脂肪组织失调。脂肪病变,主要意味着脂肪细胞过度肥大,导致脂肪组织旁分泌与内分泌失调,并且与心血管疾病相关。脂肪组织这种功能与结构的改变,有助于引起衰老相关的症状,包括身体(体重下降、肌肉衰减症)与功能减弱(日常生活能力受损)。
表二,列举了目前,人体内被广泛研究的脂肪因子。这些分子可以根据主要作用分类,如下表所示。然而,每个脂肪因子可以有多种功能,并且可以有功能的重叠。例如:瘦素、脂联素、抵抗素、纤溶酶原激活物抑制剂(PAI-1),肝细胞生长因子(HGF)与神经生长因子(NGF) 等参与了炎症、内皮功能障碍、高血压、动脉粥样硬化等过程。
另外,脂肪因子能够与非脂肪激素相互作用,放大彼此的功能。胰岛素能够直接作用于下丘脑核,而瘦素与胰岛素,均是胰岛素抵抗的调节因子,例如观察性研究显示,下丘脑处阿片促黑激素皮质素原 (POMC)
神经元表达瘦素与胰岛素受体,并且调节能量平衡与糖代谢。而 POMC
神经元缺少瘦素与胰岛素受体的小鼠模型,会表现出系统性胰岛素抵抗。因此,胰岛素与瘦素对 POMC
神经元的直接作用,可能是维持正常糖代谢所必须的。
表二:可能与 AD
相关的脂肪因子
能量平衡与代谢
炎症
血栓与高压
生长因子
棕色脂肪
1.Adiponectin/脂联素;
2.Adipsin (complement factor D)/降脂素(补体因子D);
3.Dipeptidyl peptidase-4/二肽基酶IV;
4.Leptin/瘦素;
5.Omentin/网膜素;
6.Lipocalin2/脂质运载蛋白2;
7.Resistin/抵抗素;
8.Retinol binding protein-4/视黄醇结合蛋白-4;
9.Vaspin/内脏脂肪特异性丝氨酸蛋白酶抑制剂;
10.Visfatin (pre-B-cell enhancing factor)/内脂素(前B细胞增强因子)
1.Interleukin 6/白细胞介素6(IL-6);
2.IL-10 ;
3.IL-1;
4.IL-8;
5.MCP-1/单核细胞趋化蛋白1;
6.TNFα/肿瘤坏死因子α
1.Serum amyloid A/血清淀粉样蛋白A;
2.C-reactive protein/C反应蛋白;
3.PAI-1/纤溶酶原激活物抑制剂;
4.Proteins of the renin angiotensin system/肾素-血管紧张素系统蛋白
1.Nerve growth factor/神经生长因子(NGF);
2.Hepatocyte growth factor/肝细胞生长因子(HGF)
1.Fibroblast growth factor 21/成纤维生长因子21;
2.IL-6;
3.Insulin-like growth factor 1/胰岛素样生长因子1
接下来,研究者首先探讨流行病学研究中,所报道的与痴呆相关的脂肪因子;其次,选择性阐述了由于自身生物学功能,而可能与脑病变、痴呆相关的脂肪因子。尽管,本文提示脂肪因子可能是连接肥胖与痴呆的关键因素,但目前没有针对脂肪因子或其它与认知障碍 /
痴呆相关因素的药理学干预手段。
能量平衡与代谢
(一)瘦素 :
瘦素是一个分子量为 16kDa
的蛋白类激素,主要由脂肪组织分泌,并且与 BMI
正相关。外周瘦素能够进入 CNS
与脑脊液内,并且作用于脑内特定区域,如下丘脑或海马区。另外,瘦素除了能够被转运至 CNS
外,一些研究提示,人类以及大鼠脑内也会产生瘦素(如下丘脑、大脑皮层、小脑)。瘦素主要通过瘦素受体 A
的作用,而穿过血脑屏障;其它转运机制尚未研究清楚。
瘦素具有调节食物摄取与能量消耗,改善胰岛素敏感性、促进脂肪分解、抑制脂肪形成等作用。并且,瘦素是目前研究最广泛的,与大脑结构及功能相关的脂肪因子,对大脑相关的认知及老化有一定作用。
瘦素能够影响下丘脑功能,以及由海马区控制的学习与记忆过程。试验性数据显示,瘦素能够与其它脂肪因子直接作用于下丘脑核(如弓状核),并通过产生食欲素与厌食肽调节能量消耗及食物摄取。另外,瘦素有利于海马 CA1
神经元突触前、突触后递质释放,从而改善相关的学习与记忆功能。在小鼠内,瘦素可能在最早期阶段参与下丘脑形成,从而加强认知。
在体外,瘦素降低β-
分泌酶的活性,增加 APOE-
依赖的β淀粉样蛋白(Aβ)摄取,并且通过脂解机制反过来影响 Aβ。人类研究提示,高浓度瘦素及高 BMI
值与晚年痴呆风险的降低相关。长期随访与横断面研究显示瘦素与痴呆间没有关系。
因为相比于发展为痴呆的患者,瘦素水平在没有发展为痴呆的成人中更高(痴呆前驱期),所以瘦素的潜在作用之一可能是增强认知。考虑到瘦素与 BMI
相关痴呆间的密切关系,进一步研究需要关注健康老年个体中瘦素的独立作用。
(二)脂联素
脂联素(ACRP30)主要以三聚体、六聚体和高分子量多聚体 3
种形式存在;可以调节 CNS
与外周的炎症反应,能量消耗,食物摄取,以及一些代谢进程,包括葡萄糖调节与脂肪酸分解代谢。它是一种有效的胰岛素增敏剂,并且循环浓度与胰岛素、代谢综合征、肥胖、2
型糖尿病、心血管疾病呈负相关。
相比于肥胖、糖尿病、心血管疾病中的总脂联素,高分子量脂褐素或高分子量脂联素与总脂联素之比,或许可以更好的指示胰岛素敏感性。脂联素只能通过脂肪组织生成。然而,在人类及大鼠脑脊液内,能够检测到三聚体或低分子量脂联素。在人类研究中,脑脊液(CSF)与血浆内脂联素比值,低于大鼠 1000
倍。并且,CSF
内无法检测到高分子量脂联素,均提示只有小的脂联素才能够通过血脑屏障。因此,目前脑内脂联素的来源,仍然无法确定。
脂联素的作用,主要受到脂联素两种受体调节(AdipoR1、AdipoR2)。这些受体的表达于脂肪组织、脑、卵巢、胎盘、子宫内膜中。并且,AdipoR1
与 AdipoR2
还广泛存在于中枢神经系统、脑微血管、下丘脑、海马及脑干中。
一项前瞻性研究提示,晚年(年龄≥70
岁)女性 BMI
与血内高分子量脂联素的浓度间负相关。而脂联素与 BMI
间的反向相关性,可能导致预想的高脂联素浓度与痴呆及阿尔茨海默症发病率相关;因为在临床诊断之前及诊断之后,痴呆个体倾向于丧失体重。
(三)降脂素 /
补体因子 D
血浆降脂素与年龄负相关,并且可能与 BMI、WHR
及超重、肥胖正相关。人类观察性研究,并未发现降脂素与痴呆间具有相关性。
血栓与高压
(
四 )PAI-1/
纤溶酶原激活物抑制剂 -1:
肥胖儿童、青少年、成年个体,血浆 PAI-1
的增加,主要是脂肪细胞分泌的结果。PAI-1
通过抑制组织型纤溶酶原激活剂与尿激酶型组织纤溶酶原激活剂,而影响血管健康。中央肥胖的成人与纤溶作用降低相关,可能是由于 PAI-1
的增加所导致。
尽管,外周 PAI-1
与肥胖相关,但外周 PAI-1
可能不会影响脑内进程;因为尚未发现能够携带 PAI-1
穿过血脑屏障的转运机制。在小鼠中,脑内 PAI-1
通过小胶质细胞与星形胶质细胞产生,能够调节凋亡、轴突存活、小胶质细胞的迁移。另外,体外研究显示 PAI-1
有助于轴突、树突的存活。
一些研究探索了 PAI-1
与脑组织型纤溶酶原激活物间的相互作用,但是数据不明确。组织型纤溶酶原激活剂由内皮细胞产生,调节纤维蛋白溶解,能够穿过完整的血脑屏障。因为 PAI-1
抑制组织型纤溶酶原激活物,而脑内内源性组织型纤溶酶原激活物,在衰老及痴呆进程中可能起到保护作用。
另外,脑内淀粉样蛋白能够诱导组织型纤溶酶原激活物形成,从而增加纤维蛋白溶酶的浓度,降解 Aβ42
淀粉样蛋白。然而,在大脑内,组织型纤溶酶原激活物还可能有神经毒性、导致 tau
蛋白过磷酸化,介导淀粉样毒性。唯一一项鉴定 PAI-1
与血管性痴呆的研究显示,相比于对照组,AD
组患者脑内组织型纤溶酶原激活物 mRNA
表达增加。
炎症
(五)白细胞介素:
一些脂肪因子,尤其是白细胞介素,与炎症过程相关,并且涉及痴呆。肥胖以慢性低炎症状态为特征,部分通过前炎症脂肪因子产物,如 IL-4、IL-6
等调节。
IL-6
是一种免疫调节细胞因子,可以通过饱和转运机制,透过血脑屏障,进入 CSF
与脑实质内。在雄性小鼠内,脑脊液中 50%
的 IL-6 以及脑实质内 16%
的 IL-6
来自外周分泌。啮齿类动物的研究显示,脑内 IL-6
由星形胶质细胞、胶质细胞、脑微血管内皮细胞产生。另外,痴呆中淀粉样蛋白沉积以及其他神经病变结果与脑内局部炎症相关,并且以白细胞介素、TNFα及其它前炎症物质的释放为特征。
海马主要容易受到 IL-6
的副作用,影响啮齿类动物脑内突触可塑性以及神经形成的功能。在小鼠下丘脑,IL-6
可以修饰瘦素及其他厌食症信号。而对早发型儿童及青少年肥胖 IL-6
的评估提示,IL-6
通过抑制神经形成,降低突触可塑性,影响学习与记忆功能(海马区)而与脑功能负相关,继而增加肥胖个体认知缺陷的风险。
在中年个体中,血浆 IL-6
浓度增加与海马灰质体积的降低相关。而与痴呆及轻度认知障碍相关的白细胞介素的研究显示,白细胞介素浓度主要在轻度认知障碍及痴呆患者中升高。
(六)单核细胞趋化蛋白 -1(MCP-1):
循环内单核细胞趋化蛋白 -1(MCP-1)是另一种系统性炎症标志物。在体外胰岛素抵抗脂肪细胞模型以及胰岛素抵抗肥胖小鼠体内,胰岛素能够诱导大量 MCP-1
的分泌与表达。
高浓度 MCP-1
蛋白能够导致脂肪细胞去分化,以及与高胰岛素血症和肥胖相关的持续病理状态,包括 2
型糖尿病。遗传性肥胖糖尿病小鼠模型(db/db)与高脂饮食诱导的野生型肥胖小鼠中,有报道称脂肪组织内 mRNA
及蛋白水平的 MCP-1 增加。另外血浆 MCP-1,与创伤性脑损伤(TBI)严重程度及额叶皮层轴索纤维完整性相关。并且 MCP-1,被认为是创伤性脑损伤患者,罹患 AD
的风险标志物。
生长因子
(七)肝细胞生长因子(HGF):
HGF,又称为作散射因子或肝细胞生长素。有报道称,肥胖成人与青少年中 HGF
浓度增加。HGF
是一种多功能营养因子,与受体 MET 结合,进而激活酪氨酸激酶信号通路。HGF
可以由神经元或非神经元细胞生成,MET
在神经元内高表达。在胚胎发育过程中,HGF
发挥神经诱导、轴突趋化、血管形成、神经保护存活等作用。成人体内 HGF
的生产,受到缺血性损伤以及 AD
所诱导。
HGF
有助于改善缺血导致的记忆障碍。脑内可以发现 HGF mRNA,脑皮质与白质内显示有 HGF-
样免疫反应。共聚焦显微镜确认 HGF
表达于 GFAP
阳性的星形胶质细胞、LN3-
阳性的小胶质细胞。相比于年龄匹配的对照组,AD
患者脑内 HGF
表达增加,并且与 AD
过程中的胶质形成、小胶质细胞增殖相关。在啮齿类动物中,HGF
与其它生长因子,显示有加速神经保护、血管形成、以及大脑再生的作用。
(八)神经生长因子 /HGF
NGF
是脂肪组织分泌的神经营养因子,研究显示,NGF
与神经元存活、分化、神经纤维生长相关。另外,NGF
具有抑制体外淀粉样蛋白前体(APP)的淀粉样形成过程,或许可作为 AD
的潜在干预手段。
NGF
可为外周或中枢来源,因为 NGF
已经证明可以穿过血脑屏障。很少有研究评估循环 NGF
与认知预后间的关系,尽管 NGF
增多被认为是一种潜在 AD
的干预手段,通过保护胆碱能系统。相比于年龄匹配的对照组,有研究显示,AD
患者血清 NGF
降低。但相反的是,有研究报道称,AD
患者 CSF
内 NGF
浓度高于健康对照组。另外,NGF
也被提示为 TBI
的治疗手段之一,而 TBI
是痴呆的风险因素之一。
在中国开展的一项研究,评估了人体测量指标与脂肪因子间的关系,结果显示 WHR
与循环 NGF、瘦素浓度正相关。在这项研究中,BMI、WHR
还与 HGF
平均浓度、PAI-1
浓度正相关。
表三:关注脂肪因子浓度与临床痴呆 /AD/
认知障碍相关性的流行病学研究
样本量
年龄
观察时
长(年)
研究
类型
结果
瘦素
Prospective Population Study in Gothenburg,Sweden
1462
38-60
24
纵向
研究
中年瘦素水平与女性晚发型痴呆无关
Framingham Heart Study, USA
785
79
8.3
纵向
瘦素水平升高与痴呆及AD风险降低相关;血浆瘦素浓度与更高的脑容量相关。
Study of Osteoporotic Fractures
579
82.6
5
纵向
与BMI≥25kg/m2的女性相比,BMI<25 kg/m2,的女性中,瘦素每差异0.91ng/mL,与痴呆/MCI可能性降低32%相关;
Health ABC Study,USA
2871
73.7
4
纵向
高瘦素组老年群体,认知减退的可能性更低
Case-control study,Japan
60
79
0
横向
AD与对照组间平均瘦素浓度没有差异
脂联素
Framingham
Heart Study
826
中位
76
13
纵向
总脂联素浓度与女性AD、全因痴呆风险增加相关
Rochester Epidemiology Project, USA
890
中位
80
0
横向
病例对照研究中,总脂联素与MCI无关
Case-control study,Japan
60
79
0
横向
AD组与对照组,平均总脂联素水平无差异
Clinical case series,Japan
28对照组、18MCI、27AD
74.7
0
横向
MCI与AD患者血浆脂联素水平高于对照组;MCI组CSF内脂联素水平高于对照组
Clinical case series of MCI and AD, Brazil
157
71
0
横向
MCI、AD组总脂联素水平降低,脂联素不能预测MCI向AD的进展
白细胞介素
Framingham
Heart Study
691
79
7
纵向
外周血单核细胞产生的IL-1与AD风险正相关
Health ABC Study
665高炎症,1967低炎症
73.5
4
纵向
代谢综合症的患者中,C反应蛋白以及IL-6水平中位数升高,与发展为认知障碍风险增加相关
Rochester Epidemiology Project, USA
890
中位数80
0
横向
病例对照研究中,IL-6与轻度认知障碍无关
Case-control study,Japan
60
79
0
横向
AD组平均IL-6浓度高于对照组
PAI-1
Case-control study,Japan
60
79
0
横向
AD组平均PAI-1浓度高于对照组
结论与未来方向
目前关于脂肪因子与临床痴呆或认知障碍相关性间的研究很少,尽管发表的流行病学数据支持肥胖(通过人体测量)与痴呆 /AD
间具有相关性。
但这些证据仍具有局限性。首先脂肪因子并不单单通过脂肪组织分泌。并且依据作用机制与涉及的组织,不同脂肪因子可能有不同作用。这种情况下,脂肪因子适合用作系统生物学方法的标志物,或是风险统计标志物;但却难以提示与脂肪组织相关的神经退行性病变或血管机制。
许多脂肪因子与人体测量的超重及肥胖无关,可能由于人体测量没有很好评估脂肪组织的数量,或脂肪组织不是这些脂肪因子的主要来源,亦或者因为脂肪因子的释放与脂肪组织的含量无关。另外,外周脂肪因子的功能,并不一定与脑内相似(如 PAI-1)。
这一发现要求我们继续加深对脂肪因子作用的理解,并且需要开展更多的研究来探索脂肪因子血脑屏障的转运过程,以及与其它脂肪因子间的相互作用。另外,还要考虑性别、种族、民族差异对脂肪因子浓度的影响。
人类有生之年,BMI
的情况如图二所示,并且 BMI
与年龄、痴呆、死亡率间相关性的改变,提示检测 BMI
时年龄的重要性,以及痴呆发作时间点(老年、中年)的差异。尽管,成人 BMI
增高,能够增加慢性神经退行性病变与年龄相关血管性疾病的风险;但一些研究显示,BMI-
痴呆相关性,在晚年降低。这可能由于中年时期,高 BMI
及中心肥胖与引起痴呆的主要风险(血管风险)相关;而在晚年,BMI
降低参与神经退行性病变过程。
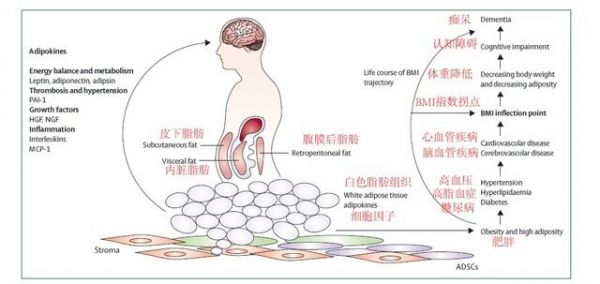
图二:生命进程中,BMI
变化轨迹以及年龄、脂肪因子的潜在作用 (ADSCs:脂肪源性干细胞)
有研究显示,在轻度认知障碍患者中,基线期 BMI
值较高与更差的临床痴呆预后相关,但随后体重下降与临床症状加剧相关。然而,并非所有观察性研究均得到一致的结果。这些发现提示,衰老与痴呆进程,可能涉及由不同脂肪因子调节的生物学机制,而痴呆预后的异质性,反应了脑内血管与神经退行性病变进程。
最后,生存偏倚可能影响中年、晚年肥胖 -
痴呆相关性,因为竞争风险分析显示,超重或肥胖患者,有可能在到达罹患痴呆年龄前死亡。
总之,本文重点关注脂肪因子与肥胖、晚发型痴呆间的风险。尽管目前涉及脂肪因子与痴呆的流行病学和生物学机制逐渐增多,但仍然需要更好的弄清楚脂肪因子代谢的个体化差异;以及随衰老、神经退行性病变及痴呆而发生的代谢失调;另外这些代谢差异可能受到饮食、体力活动、种族与遗传的影响。
脂肪因子的单一或联合疗法,应该是未来预防认知障碍及痴呆的新途径之一,例如目前有报道提出瘦素治疗。最后,脂肪因子作为一种生物标志物,可能有助于我们对晚发型痴呆风险,临床痴呆前驱期及发作过程的理解。而这些信息,有助于鉴定高危人群,以及更好临床试验的设计,旨在靶向研究与脂肪组织(外周、中心)相关的血管与代谢风险。
相关知识
肚子越大,脑子越小!研究发现,腹部脂肪加速大脑萎缩,增加痴呆风险
睡眠障碍与认知功能的关系(柳叶刀综述)
柳叶刀重磅综述:成人肥胖症的现代医学疗法
《柳叶刀》综述:近五年成人肥胖症最新治疗进展
柳叶刀重磅综述:成人肥胖症的现代医学疗法@MedSci
“健康的胖子”,真的存在吗?《柳叶刀》子刊提出“代谢健康”新定义
中国人越来越胖,原因何在?《柳叶刀》发文了
《柳叶刀》综述:腰痛已成全球性疾病!哪些因素易诱发腰痛?
《柳叶刀》子刊:肥胖加速衰老,与52种疾病风险升高有关!
瘦、正常、胖,哪种状态“老痴”风险更高?
网址: 脂肪因子:连接肥胖与痴呆(柳叶刀综述) https://www.trfsz.com/newsview649104.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828